![]()
Novedades
Física

Química

Blog Departamento:
Últimas noticias
Física – Química
Concurso Científico-Tecnológico IES Alhambra 2024
Desde el área Científico-Tecnológica os proponemos un concurso de fotografía. En este concurso podrá participar toda la comunidad educativa del IES Alhambra en alguno de los siguientes niveles: NIVEL I: AULA TEA, 1º ESO, 2º ESO NIVEL II: 3º ESO, 4º ESO NIVEL III:...
VIAJE CIENTÍFICO-TECNOLÓGICO. 4º DE ESO
Desde la Coordinación del área Científico-Tecnológica del IES Alhambra proponemos al alumnado de 4⁰ de ESO un VIAJE CIENTÍFICO Y TECNOLÓGICO de DOS DÍAS (una noche) de duración en la 3ª evaluación del presente curso 2022/23. Las fechas confirmadas son 24 y 25 de MAYO....
CONCURSO DE FOTOGRAFÍA DEL ÁREA CIENTÍFICO-TÉCNOLÓGICA: “STOP CONTAMINACIÓN VISUAL”
ATENCIÓN: SE AMPLIA EL PLAZO DE PRESENTACIÓN HASTA EL PRÓXIMO 17 DE ABRIL A LAS 24 HORAS Desde el área Científico-tecnológica os proponemos un concurso de fotografía. En este concurso podrá participar toda la comunidad educativa del IES Alhambra en alguno de...
Día Internacional contra el cambio climático
Segunda actividad que realizamos dentro del Proyecto INNICIA en el IES ALHAMBRA en el curso 22/23 El pasado 24 de Octubre se conmemoraba el Día Internacional contra el Cambio Climático. El Departamento de Física y Química, a través de las actividades del Proyecto...
Llegó la mochila ecológica
El pasado 20 de Diciembre en los grupos de 3º de ESO se realizó la actividad: “Huella y mochila ecológica” a cargo de María, representando al Ayuntamiento. Se trata de concienciarnos acerca del desperdicio de recursos y cómo afecta al medio ambiente. El profesorado...
Step into space
Adaptación de la exposición de la ESA “ STEP INTO SPACE”, inaugurada en el centro el viernes 26 de marzo. La exposición constituye el eje vertebrador para divulgar el proyecto STEAM “Investigación Aeroespacial Aplicada al aula” a toda la comunidad educativa. Viva en...
Componentes:
Estructura del Departamento Física y Química
Funcionamiento:
Organización del departamento
El Departamento imparte las asignaturas de Física y Química desde segundo de ESO hasta segundo de Bachillerato.
Een segundo y tercero de ESO la enseñanza que se imparte está dentro del Programa Bilingüe
Materias:
Asignaturas que se desarrollan desde el departamento:
- Física y Química Bilingüe 2º y 3º ESO
- Física y Química 4º ESO
- Física y Química 1º Bachillerato
- Proyecto Laboratorio 1º Bachillerato
- Química 2º Bachillerato
- Física 2º Bachillerato
- Ámbito Científico Tecnológico 4º ESO
Descripción:
Breve presentación de las diferentes materias:
Física y Química ESO
La materia Física y la Química juegan un papel decisivo para comprender el funcionamiento del universo y las leyes que lo gobiernan, proporcionando a los alumnos y alumnas los conocimientos, destrezas y actitudes de la ciencia que les permita desenvolverse con un criterio fundamentado en un mundo en continuo desarrollo científico, tecnológico, económico y social, promoviendo acciones y conductas que provoquen cambios hacia un mundo más justo e igualitario. La Física y Química es una materia englobada en lo que se conoce como disciplinas STEM, propone el uso de las metodologías propias de la ciencia, abordadas a través del trabajo cooperativo interdisciplinar y su relación con el desarrollo socioeconómico, que estén enfocadas a la formación de alumnos y alumnas competentes, comprometidos con los retos del mundo actual y los objetivos de desarrollo sostenible, proporcionando a la materia un enfoque constructivo, crítico y emprendedor.
En cuanto a los saberes básicos de esta materia, contemplan conocimientos, destrezas y actitudes básicas de estas áreas de conocimiento y se encuentran estructurados en los que tradicionalmente han sido los grandes bloques de conocimiento de la Física y la Química: «La materia», «La energía», «La interacción» y «El cambio». Además, este currículo propone la existencia de un bloque de saberes comunes denominado «Las destrezas científicas básicas» que hace referencia a las metodologías de la ciencia y a su importancia en el desarrollo de estas áreas de conocimiento.
La materia se divide en cinco grandes bloques en cada uno de los cursos de la ESO:
• El bloque 1, las destrezas científicas básicas: hace referencia a las metodologías de la ciencia y a su importancia en el desarrollo de estas áreas de conocimiento. En este bloque se establece, además, la relación de la ciencia con una de sus herramientas más potentes, las matemáticas, que ofrecen un lenguaje de comunica-ción formal, incluyendo los conocimientos previos del alumnado y los que se adquieren a lo largo de esta etapa educativa.
• EL bloque 2, la materia: se trabajan los conocimientos básicos sobre la constitución interna de las sustancias, describiendo cómo es la estructura de los elementos y de los compuestos químicos y las propiedades macroscópicas y microscópicas de la materia, preparándose para profundizar en estos contenidos en cursos posteriores.
• El bloque 3, la energía: el alumnado profundiza en los conocimientos como las fuentes de energía y sus usos prácticos o los conceptos básicos acerca de las formas de energía. Adquiere, además, en esta etapa las destrezas y las actitudes que están relacionadas con el desarrollo social y económico del mundo real y sus implicaciones medioambientales.
• El bloque 4, la interacción: se describen cuáles son los efectos principales de las interacciones fundamentales de la naturaleza y el estudio básico de las principales fuerzas del mundo natural, así como sus aplicaciones prácticas en campos ta-les como la astronomía, el deporte, la ingeniería, la arquitectura o el diseño.
• El bloque 5, el cambio: aborda las principales transformaciones físicas y químicas de los sistemas materiales y naturales, así como los ejemplos más frecuentes del entorno y sus aplicaciones y contribuciones a la creación de un mundo mejor.
Ámbito Científico Tecnológico 4º
El desarrollo curricular del ámbito Científico-Tecnológico de los programas de Di-versificación curricular responde a los propósitos pedagógicos de estas enseñanzas: en primer lugar, facilitar la adquisición de las competencias de la Educación Secundaria Obligatoria a través de la integración de las competencias específicas, criterios de evaluación y sabe-res básicos de las materias Matemáticas, Física y Química, y Biología y Geología en un mismo ámbito; en segundo lugar, contribuye al desarrollo de competencias para el aprendizaje permanente a lo largo de la vida, con el fin de que el alumnado pueda proseguir sus estudios en etapas postobligatorias.
Los saberes básicos relacionados con las materias de Física y Química, y Biología y Geología se agrupan en bloques «las destrezas científicas básicas», «la célula», «seres vi-vos», «la materia», «la energía», «la interacción», «ecología y sostenibilidad», «cuerpo humano», «hábitos saludables», «salud y enfermedad», «el cambio» y por último «Geología», que abarcan conocimientos, destrezas y actitudes, con la finalidad de proporcionar al alumnado unos aprendizajes esenciales sobre la ciencia, sus metodologías y sus aplicaciones laborales para configurar su perfil personal, social y profesional. Los saberes básicos de esta materia permitirán al alumnado analizar la anatomía y fisiología de su organismo y los hábitos saludables para cuidarlo, establecer un compromiso social con la salud pública, examinar el funcionamiento de los sistemas biológicos y geológicos y valorar la importancia del desarrollo sostenible, explicar la estructura de la materia y sus transformaciones, analizar las interacciones entre los sistemas fisico-químicos y la relevancia de la energía en la sociedad.
Proyecto de Investigación de Laboratorio (1º BACH)
El proyecto va orientado hacia el alumnado de Ciencias de 1º y 2º de Bachillerato, dado que el currículum de Física y Química de estos cursos tiene una importante carga en contenidos, muy difícil de desarrollar en su totalidad, que impide desarrollar en el alumnado las habilidades y destrezas que debería adquirir un alumnado de Ciencias.
El estudio de diversos temas con un enfoque investigador, centrado en la búsqueda de soluciones a los problemas planteados, permitirá al alumnado conocer mejor algunos de los aspectos que caracterizan la elaboración del conocimiento científico, como son la elaboración de hipótesis, diseño y realización de experiencias para contrastarlas, análisis de resultados, comunicación de los mismos, etc. Este Proyecto es también una oportunidad para estudiar temas de interés y de actualidad, reforzando la conexión entre ciencia y realidad, y haciendo que el alumnado comprenda que la ciencia ha evolucionado a lo largo de la historia y que existe una fuerte relación entre Ciencia, Tecnología y Sociedad.
Física y Química 1º Bachillerato
La materia de Física y Química de 1º de Bachillerato es materia específica de la modalidad del bachillerato de Ciencias y Tecnología. Con ella se pretende dotar al alumna-do de capacidades específicas asociadas a esta disciplina. Muchos de los contenidos y capacidades a desarrollar ya han sido introducidos en la Educación Secundaria Obligatoria (ESO) y sobre ellos se van a profundizar. Se ha compensado el contenido curricular entre la Física y la Química, para que se pueda impartir cada una de ellas en un cuatrimestre.
Física 2º Bachillerato
La Física, como disciplina que estudia la naturaleza, se encarga de entender y describir el Universo, desde los fenómenos que se producen en el microcosmos hasta aquellos que se dan en el macrocosmos. La materia, la energía y las interacciones se comportan de forma distinta en las diferentes situaciones, lo que hace que los modelos, principios y leyes de la Física que el alumnado ha de aplicar para explicar la naturaleza deban ajustarse a la escala de trabajo y a que las respuestas que encuentre serán siempre aproximadas y condicionadas por el contexto. Resulta adecuado que el alumnado perciba la Física como una ciencia que evoluciona, y reconozca también que los conocimientos que implica la relacionan íntimamente con la tecnología, la sociedad y el medioambiente, lo que la convierte en una ciencia indispensable para la formación individual de cada estudiante de la modalidad de Ciencias y Tecnología, pues le permite formar parte activa de una ciencia en construcción a partir del análisis de su evolución histórica y de las destrezas que adquiere para ob-servar, explicar y demostrar los fenómenos naturales.
Química 2º Bachillerato
En la naturaleza existen infinidad de procesos y fenómenos que la ciencia trata de explicar a través de sus diferentes leyes y teorías. El aprendizaje de disciplinas científicas empíricas como la Química fomenta en los estudiantes el interés por comprender la realidad y valorar la relevancia de esta ciencia tan completa y versátil a partir del cono-cimiento de las aplicaciones que tiene en distintos contextos. Mediante el estudio de la Química se consigue que el alumnado desarrolle competencias para comprender y describir cómo es la composición y la naturaleza de la materia y cómo se transforma. En-tender los fundamentos de los procesos y fenómenos químicos, comprender cómo funcionan los modelos y las leyes de la Química y manejar correctamente el lenguaje químico forman parte de las competencias específicas de la materia. Se profundiza también en otros aspectos referidos al buen concepto de la Química como ciencia, y sus relaciones con otras áreas de conocimiento, al desarrollo de técnicas de trabajo propias de pensamiento científico, y se analiza y reflexiona sobre las repercusiones de la Química en los contextos industrial, sanitario, económico y medioambiental de la sociedad actual, completando así la formación competencial del alumnado y proporcionándole un perfil adecuado para desenvolverse según las demandas del mundo real.
Grupos:
Grupo – materia – profesor/a:
D. Mario Delgado Bonet
- Física y Química, 3º ESO A, B, C Bilingüe.
- Química, 2º Bachillerato.
- Tutoría 2º ESO C
Dª María Molina Jiménez
- Física y Química, 4º ESO
- Física y Química, 1º Bachillerato
- Física, 2º Bachillerato
- Proyecto de Laboratorio, 1º Bachillerato
- Jefatura de Departamento
Dª Mª Visitación Torres Ruano
- Física y Química, 2º ESO A, B, y C, Bilingüe.
- Ámbito Científico Tecnológico Diversificación, 4º ESO.
- Tutoría de 3º ESO A
Contenido:
Temario por materias:
Física y Química 2º ESO
- A. Las destrezas científicas básicas.
FYQ.2.A.1. Metodologías de la investigación científica: identificación y formulación de cuestiones, elaboración de hipótesis y comprobación experimental de las mismas.
FYQ.2.A.2. Trabajo experimental y proyectos de investigación: estrategias en la resolución de problemas y en el desarrollo de las investigaciones mediante la indagación, la deducción, la búsqueda de evidencias y el razonamiento lógico-matemático, haciendo inferencias válidas de las observaciones y obteniendo conclusiones.
FYQ.2.A.3. Diversos entornos y recursos de aprendizaje científico, como el laboratorio o los entornos virtuales: materiales, sustancias y herramientas tecnológicas, atendiendo a las normas de uso de cada espacio para asegurar la conservación de la salud
propia y comunitaria, la seguridad en redes y el respeto hacia el medioambiente.
FYQ.2.A.4. Uso del lenguaje científico, incluyendo el manejo adecuado de sistemas de unidades, utilizando preferentemente el Sistema Internacional de Unidades y la notación científica para expresar los resultados, y herramientas matemáticas, para conseguir una comunicación argumentada con diferentes entornos científicos y de aprendizaje.
FYQ.2.A.5. Interpretación y producción de información científica en diferentes forma-tos y a partir de diferentes medios para desarrollar un criterio propio basado en lo que el pensamiento científico aporta a la mejora de la sociedad para hacerla más
justa, equitativa e igualitaria.
FYQ.2.A.6. Valoración de la cultura científica y del papel de
científicos y científicas en los principales hitos históricos y actuales de la física y la química para el avance y la mejora de la sociedad. La Ciencia en Andalucía.
B. La materia.
FYQ.2.B.1. Teoría cinético-molecular: aplicación a observaciones sobre la materia para explicar sus propiedades, los estados de agregación y los cambios de estado, y la forma-ción de mezclas y disoluciones, así como la concentración de las mismas y las leyes de los gases ideales.
FYQ.2.B.2. Realización de experimentos relacionados con los sistemas materiales para conocer y describir sus propiedades; densidad, composición y clasificación, así como los métodos de separación de una mezcla.
C. La energía.
FYQ.2.C.1. Formulación de cuestiones e hipótesis sobre la energía, el calor y el equilibrio térmico, sus manifestaciones y sus propiedades, y explicación del concepto de temperatura en términos del modelo cinético-molecular, para describirla como la causa de todos los procesos de cambio. FYQ.2.C.2. Diseño y comprobación experimental de hipótesis, relacionadas con el uso doméstico e industrial de la energía en sus distintas formas y las transformaciones entre ellas.
FYQ.2.C.3. Elaboración fundamentada de hipótesis sobre el medioambiente y la sostenibilidad a partir de las diferencias entre fuentes de energía renovables y no renovables. Energías renovables en Andalucía.
FYQ.2.C.4. Análisis y aplicación de los efectos del calor sobre la materia para aplicar-los en situaciones cotidianas.
D. La interacción.
FYQ.2.D.1. Identificación de magnitudes que caracterizan un movimiento: posición, trayectoria, desplazamiento y distancia recorrida. Valoración de la importancia de la identificación de un sistema de referencia. Predicción de movimientos sencillos a partir de los conceptos de la cinemática posición, velocidad y aceleración, para formular hipó-tesis comprobables sobre valores futuros de estas magnitudes, y validación de dichas hipótesis a través del cálculo numérico, la interpretación de gráficas o el trabajo experimental.
FYQ.2.D.2. Aproximación al concepto de fuerza. Las fuerzas como agentes de cambio: relación de los efectos de las fuerzas, tanto en el estado de movimiento o de reposo de un cuerpo como produciendo deformaciones en los sistemas sobre los que actúan. Máquinas simples.
E. El cambio.
FYQ.2.E.1. Análisis de los diferentes tipos de cambios que experimentan los sistemas materiales para relacionarlos con las causas que los producen y con las consecuencias que tienen.
FYQ.2.E.2. Interpretación de las reacciones químicas a nivel macroscópico y microscópico, en términos del modelo atómico-molecular de la materia y de la teoría de colisiones, para explicar las relaciones de la química con el medioambiente, la tecnología y la sociedad.
Física y Química 3º ESO
La materia se divide en cinco grandes bloques de saberes básicos:
Bloque A : Las destrezas científicas básicas.
FYQ.3.A.1. Metodologías de la investigación científica: identificación y formulación de cuestiones, elaboración de hipótesis y comprobación experimental de las mismas.
FYQ.3.A.2. Trabajo experimental y proyectos de investigación: estrategias en la resolución de problemas y en el desarrollo de las investigaciones mediante la indagación, la deducción, la búsqueda de evidencias y el razonamiento lógico-matemático, haciendo inferencias válidas de las observaciones y obteniendo conclusiones.
FYQ.3.A.3. Diversos entornos y recursos de aprendizaje científico, como el laboratorio o los entornos virtuales: materiales, sustancias y herramientas tecnológicas, atendiendo a las normas de uso de cada espacio para asegurar la conservación de la salud propia y comunitaria, la seguridad en redes y el respeto hacia el medioambiente.
FYQ.3.A.4. Uso del lenguaje científico, incluyendo el manejo adecuado de sistemas de unidades, utilizando preferentemente el Sistema Internacional de Unidades y la notación científica para expresar los resultados, y herramientas matemáticas, para conseguir una comunicación argumentada con diferentes entornos científicos y de aprendizaje.
FYQ.3.A.5. Interpretación y producción de información científica en diferentes formatos y a partir de diferentes medios para desarrollar un criterio propio basado en lo que el pensamiento científico aporta a la mejora de la sociedad.
FYQ.3.A.6. Valoración de la cultura científica y del papel de científicos y científicas en los principales hitos históricos y actuales de la física y la química para el avance y la mejora de la sociedad. La Ciencia en Andalucía.
Bloque B: La materia
FYQ.3.B.1. Teoría cinético-molecular: aplicación a observaciones sobre la materia para explicar sus propiedades, los estados de agregación y los cambios de estado, y la formación de mezclas y disoluciones, así como la concentración de las mismas y las leyes de los gases ideales.
FYQ.3.B.3. Aplicación de los conocimientos sobre la estructura atómica de la materia para entender y explicar la formación de estructuras más complejas, de iones, la existencia de isótopos y sus propiedades, el desarrollo histórico del modelo atómico y la ordenación y clasificación de los elementos en la Tabla Periódica.
FYQ.3.B.4. Principales compuestos químicos: su formación y sus propiedades físicas y químicas, valoración de sus aplicaciones. Masa atómica y masa molecular.
FYQ.3.B.5. Participación de un lenguaje científico común y universal a través de la formulación y nomenclatura de sustancias simples, iones monoatómicos y compuestos binarios mediante las reglas de nomenclatura de la IUPAC.
Bloque C: La energía
FYQ.3.C.1. Formulación de cuestiones e hipótesis sobre la energía, el calor y el equilibrio térmico, sus manifestaciones y sus propiedades, y explicación del concepto de temperatura en términos del modelo cinético-molecular, para describirla como la causa de todos los procesos de cambio.
FYQ.3.C.2. Diseño y comprobación experimental de hipótesis, relacionadas con el uso doméstico e industrial de la energía en sus distintas formas y las transformaciones entre ellas.
FYQ.3.C.3. Elaboración fundamentada de hipótesis sobre el medioambiente y la sostenibilidad a partir de las diferencias entre fuentes de energía renovables y no renovables. Energías renovables en Andalucía.
FYQ.3.C.5. Consideración de la naturaleza eléctrica de la materia y explicación del fenómeno físico de la corriente eléctrica con base en la Ley de Ohm así como diseño y construcción de circuitos eléctricos en laboratorio o de forma virtual, y la obtención de energía eléctrica para desarrollar conciencia sobre la necesidad del ahorro energético y la conservación sostenible del medioambiente.
Bloque D: La interacción
FYQ.3.C.1. Formulación de cuestiones e hipótesis sobre la energía, el calor y el equilibrio térmico, sus manifestaciones y sus propiedades, y explicación del concepto de temperatura en términos del modelo cinético-molecular, para describirla como la causa de todos los procesos de cambio.
FYQ.3.C.2. Diseño y comprobación experimental de hipótesis, relacionadas con el uso doméstico e industrial de la energía en sus distintas formas y las transformaciones entre ellas.
FYQ.3.C.3. Elaboración fundamentada de hipótesis sobre el medioambiente y la sostenibilidad a partir de las diferencias entre fuentes de energía renovables y no renovables. Energías renovables en Andalucía.
FYQ.3.C.5. Consideración de la naturaleza eléctrica de la materia y explicación del fenómeno físico de la corriente eléctrica con base en la Ley de Ohm así como diseño y construcción de circuitos eléctricos en laboratorio o de forma virtual, y la obtención de energía eléctrica para desarrollar conciencia sobre la necesidad del ahorro energético y la conservación sostenible del medioambiente.
Bloque D: La interacción
FYQ.3.C.1. Formulación de cuestiones e hipótesis sobre la energía, el calor y el equilibrio térmico, sus manifestaciones y sus propiedades, y explicación del concepto de temperatura en términos del modelo cinético-molecular, para describirla como la causa de todos los procesos de cambio.
FYQ.3.C.2. Diseño y comprobación experimental de hipótesis, relacionadas con el uso doméstico e industrial de la energía en sus distintas formas y las transformaciones entre ellas.
FYQ.3.C.3. Elaboración fundamentada de hipótesis sobre el medioambiente y la sostenibilidad a partir de las diferencias entre fuentes de energía renovables y no renovables. Energías renovables en Andalucía.
FYQ.3.C.5. Consideración de la naturaleza eléctrica de la materia y explicación del fenómeno físico de la corriente eléctrica con base en la Ley de Ohm así como diseño y construcción de circuitos eléctricos en laboratorio o de forma virtual, y la obtención de energía eléctrica para desarrollar conciencia sobre la necesidad del ahorro energético y la conservación sostenible del medioambiente.
Bloque E: El cambio
FYQ.3.E.2. Interpretación de las reacciones químicas a nivel macroscópico y microscópico, en términos del modelo atómico-molecular de la materia y de la teoría de colisiones, para explicar las relaciones de la química con el medioambiente, la tecnología y la sociedad.
FYQ.3.E.3. Aplicación de la ley de conservación de la masa y de la ley de las proporciones definidas, para utilizarlas mediante cálculos estequiométricos como evidencias experimentales que permitan validar el modelo atómico-molecular de la materia.
FYQ.3.E.4. Análisis de los factores que afectan a las reacciones químicas para predecir su evolución de forma cualitativa y entender su importancia en la resolución de problemas actuales por parte de la ciencia
Física y Química 4º ESO
A. Las destrezas científicas básicas.
FYQ.4.A.1. Diseño del trabajo experimental y emprendimiento de proyectos de investigación para la resolución de problemas mediante el uso de la experimentación y el tratamiento del error, la indagación, la deducción, la búsqueda de evidencias o el razona-miento lógico-matemático para hacer inferencias válidas sobre la base de las observaciones y sacar conclusiones pertinentes y generales que vayan más allá de las condiciones experimentales para aplicarlas a nuevos escenarios. La investigación científica. La medida y su error. Análisis de datos experimentales.
FYQ.4.A.2. Empleo de diversos entornos y recursos de aprendizaje científico, como el laboratorio o los entornos virtuales, utilizando de forma correcta los materiales, sustancias y herramientas tecnológicas y atendiendo a las normas de uso de cada espacio para asegurar la conservación de la salud propia y comunitaria, la seguridad en redes y el respeto sostenible por el medioambiente. Proyecto de investigación sencillo.
FYQ.4.A.3. Uso del lenguaje científico, incluyendo el manejo adecuado de sistemas de unidades, la determinación de la ecuación de dimensiones de una fórmula sencilla, y herramientas matemáticas básicas, para conseguir una
comunicación argumentada con diferentes entornos científicos y de aprendizaje. Las magnitudes. Ecuaciones dimensionales. El informe científico. Expresión de resultados de forma rigurosa en diferentes formatos.
FYQ.4.A.4. Interpretación y producción de información científica en diferentes forma-tos y a partir de diferentes medios para desarrollar un criterio propio basado en lo que el pensamiento científico aporta a la mejora de la sociedad para hacerla más justa, equitativa e igualitaria. Utilización de herramientas tecnológicas en el entorno científico. Se-lección, comprensión e interpretación de la información relevante de un texto de divulgación científica.
FYQ.4.A.5. Valoración de la cultura científica y del papel de científicos y científicas en los principales hitos históricos y actuales de la física y la química para el avance y la mejora de la sociedad.
B. La materia.
FYQ.4.B.1. Realización de problemas de variada naturaleza sobre las propiedades fisico-químicas de los sistemas materiales más comunes, en función de la naturaleza del en-lace químico y de las fuerzas intermoleculares, incluyendo disoluciones y sistemas gaseosos, para la resolución de problemas relacionados con situaciones cotidianas diversas.
FYQ.4.B.2. Reconocimiento de los principales modelos atómicos clásicos y cuánticos y la descripción de las partículas subatómicas de los constituyentes de los átomos estableciendo su relación con los avances de la física y de la química más relevantes de la historia reciente. Estructura electrónica de los átomos.
FYQ.4.B.3. Relación, a partir de su configuración electrónica, de la distribución de los elementos en la Tabla Periódica con sus propiedades fisico-químicas más importantes, agrupándolos por familias, para encontrar generalidades.
FYQ.4.B.4. Valoración de la utilidad de los compuestos químicos a partir de sus pro-piedades en relación con cómo se combinan los átomos, a la naturaleza iónica, covalente o metálica del enlace químico y a las fuerzas intermoleculares, como forma de reconocer la importancia de la química en otros campos como la ingeniería, la biología o el deporte.
FYQ.4.B.5. Cuantificación de la cantidad de materia de sistemas de diferente naturaleza en los términos generales del lenguaje científico, aplicación de la constante del número de Avogadro y reconocimiento del mol como la unidad de la cantidad de materia en el Sistema Internacional de Unidades para manejar con soltura las diferentes formas de medida y expresión de la misma en el entorno científico.
FYQ.4.B.6. Utilización e interpretación adecuada de la formulación y nomenclatura de compuestos químicos inorgánicos ternarios mediante las reglas de la IUPAC para contribuir a un lenguaje científico común.
FYQ.4.B.7. Introducción a la formulación y nomenclatura de los compuestos orgánicos mediante las reglas de la IUPAC como base para reconocer y representar los hidrocarburos sencillos y los grupos funcionales de alcoholes, aldehídos, cetonas, ácidos carboxílicos, ésteres y aminas para entender la gran variedad de compuestos del entorno basados en el carbono, su importancia biológica, sus múltiples usos y sus aplicaciones de especial interés.
C. La energía.
FYQ.4.C.1. Formulación y comprobación de hipótesis sobre las distintas formas de energía, y sus aplicaciones a partir de sus propiedades y del principio de conservación, como base para la experimentación y la resolución de problemas relacionados con la energía mecánica, con o sin fuerza de rozamiento, en situaciones cotidianas que les permita asumir el papel que esta juega en el avance de la investigación científica.
FYQ.4.C.2. Reconocimiento cualitativo y cuantitativo de los distintos procesos de transferencia de energía, de la velocidad a la que transcurren y de sus efectos en los cuerpos, especialmente los cambios de estado y la dilatación, en los que están implica-dos fuerzas o diferencias de temperatura, como base de la resolución de problemas cotidianos. La luz y el sonido como ondas que transfieren energía. Utilización de la energía del Sol como fuente de energía limpia y renovable.
FYQ.4.C.3. Reconocimiento cualitativo y cuantitativo de que el calor y el trabajo son dos formas de transferencia de energía para identificar los diversos contextos en que se producen y valorar su importancia en situaciones de la vida cotidiana.
FYQ.4.C.4. Aplicación del concepto de equilibrio térmico al cálculo del valor de la energía transferida entre cuerpos a distinta temperatura y al valor de la temperatura de equilibrio para resolver problemas sencillos en situaciones de la vida cotidiana.
FYQ.4.C.5. Estimación de valores de energía y consumos energéticos en situaciones cotidianas mediante la aplicación de conocimientos, la búsqueda de información contrastada, la experimentación y el razonamiento científico para debatir y comprender la importancia de la energía en la sociedad, su producción y su uso responsable; así como la importancia histórica y actual de las máquinas térmicas.
D. La interacción.
FYQ.4.D.1. Predicción y comprobación, utilizando la experimentación y el razonamiento lógico-matemático, de las principales magnitudes, ecuaciones y gráficas que describen el movimiento de un cuerpo, tanto rectilíneo como circular, para relacionarlo con situaciones cotidianas y la mejora de la calidad de vida.
FYQ.4.D.2. Aplicación de las Leyes de Newton y reconocimiento de la fuerza como agente de cambios en los cuerpos, como principio fundamental de la Física que se aplica a otros campos como el diseño, el deporte o la ingeniería.
FYQ.4.D.3. Uso del álgebra vectorial básica para la realización gráfica y numérica de operaciones con fuerzas y su aplicación a la resolución de problemas relacionados con sistemas sometidos a conjuntos de fuerzas y valoración de su importancia en situaciones cotidianas.
FYQ.4.D.4. Aplicación de la Ley de Gravitación Universal en diferentes contextos, como la caída de los cuerpos y el movimiento orbital, para interpretar y explicar situaciones cotidianas.
FYQ.4.D.5. Identificación y manejo de las principales fuerzas del entorno cotidiano, como el peso, la normal, el rozamiento, la tensión o el empuje, y su uso en la explicación de fenómenos físicos en distintos escenarios.
FYQ.4.D.6. Valoración de los efectos de las fuerzas aplicadas sobre superficies que afectan a medios líquidos o gaseosos, especialmente del concepto de presión, para comprender las aplicaciones derivadas de sus efectos.
E. El cambio
FYQ.4.E.1. Utilización de la información contenida en una ecuación química ajustada y de las leyes más relevantes de las reacciones químicas para hacer con ellas predicciones cualitativas y cuantitativas por métodos experimentales y numéricos, y relacionarlo con los procesos fisico-químicos de la industria, el medioambiente y la sociedad.
FYQ.4.E.2. Descripción cualitativa de reacciones químicas del entorno cotidiano, incluyendo las combustiones, las neutralizaciones y los procesos electro-químicos, compro-bando experimentalmente algunos de sus parámetros, para hacer una valoración de sus implicaciones en la tecnología, la sociedad o el medioambiente y de su especial importancia económica y social en Andalucía (el hidrógeno verde, los combustibles fósiles, la metalurgia y electrólisis del cobre).
FYQ.4.E.3. Aplicación de la Teoría de Arrhenius al estudio de las propiedades de los ácidos y bases, los indicadores y la escala de pH para describir su comportamiento químico y sus aplicaciones en situaciones de la vida cotidiana.
FYQ.4.E.4. Relación de las variables termodinámicas y cinéticas en las reacciones químicas, aplicando modelos como la teoría de colisiones, para explicar el mecanismo de una reacción química, su velocidad y energía, a partir de la reordenación de los átomos, así como la ley de conservación de la masa y realizar predicciones aplicadas a los procesos cotidianos más importantes.
Ámbito Científico Tecnológico DIVER 4º ESO
Se corresponden con los saberes básicos generales:
A. Sentido numérico.
D. Sentido algebraico.
ACT.2.D.1. Patrones.
ACT.2.D.2. Modelo matemático.
ACT.2.D.3. Variable. Comprensión del concepto de variable en sus diferentes naturalezas.
ACT.2.D.4. Igualdad y desigualdad.
ACT.2.D.5. Relaciones y funciones.
ACT.2.D.6. Pensamiento computacional.
E. Sentido estocástico.
ACT.2.E.1. Distribución.
ACT.2.E.2. Inferencia.
ACT.2.E.3. Predictibilidad e incertidumbre.
F. Sentido socioafectivo.
ACT.2.F.1. Creencias, actitudes y emociones.
ACT.2.F.2. Trabajo en equipo y toma de decisiones.
ACT.2.F.3. Inclusión, respeto y diversidad.
Los saberes básicos relacionados con las materias de Física y Química, y Biología y Geología se agrupan en bloques «las destrezas científicas básicas», «la célula», «seres vivos», «la materia», «la energía», «la interacción», «ecología y sostenibilidad», «cuerpo humano», «hábitos saludables», «salud y enfermedad», «el cambio» y por último «Geología», que abarcan conocimientos, destrezas y actitudes, con la finalidad de proporcionar al alumnado unos aprendizajes esenciales sobre la ciencia, sus metodologías y sus aplicaciones laborales para configurar su perfil personal, social y profesional. Los saberes básicos de esta materia permitirán al alumnado analizar la anatomía y fisiología de su organismo y los hábitos saludables para cuidarlo, establecer un compromiso social con la salud pública, examinar el funcionamiento de los sistemas biológicos y geológicos y valorar la importancia del desarrollo sostenible, explicar la estructura de la materia y sus transformaciones, analizar las interacciones entre los sistemas fisico-químicos y la relevancia de la energía en la sociedad.
Física y Química 1º Bachillerato
La materia de Física y Química de 1.º de Bachillerato es materia específica de la modalidad del bachillerato de Ciencias y Tecnología. Con ella se pretende dotar al alumnado de capacidades específicas asociadas a esta disciplina. Muchos de los contenidos y capacidades a desarrollar ya han sido introducidos en la Educación Secundaria Obligatoria (ESO) y sobre ellos se van a profundizar. Se ha compensado el contenido curricular entre la Física y la Química, para que se pueda impartir cada una de ellas en un cuatrimestre.
El estudio de la Química se ha secuenciado en cinco bloques de saberes básicos:
A. Enlace químico y estructura de la materia
FISQ.1.A.1. Desarrollo de la tabla periódica: contribuciones históricas a su elaboración actual e importancia como herramienta predictiva de las propiedades de los elementos.
FISQ.1.A.2. Estructura electrónica de los átomos: explicación de la posición de un elemento en la tabla periódica y de la variación en las propiedades de los elementos químicos de cada grupo y periodo.
FISQ.1.A.3. Teorías sobre la estabilidad de los átomos e iones: predicción de la formación de enlaces entre los elementos, representación de estos y deducción de cuáles son las propiedades de las sustancias químicas. Comprobación a través de la observación y la experimentación.
FISQ.1.A.4. Formulación y nomenclatura de sustancias simples, iones y compuestos químicos inorgánicos:
composición y las aplicaciones que tienen en la vida cotidiana.
B. Reacciones químicas
FISQ.1.B.1. Leyes fundamentales de la química: relaciones estequiométricas en las reacciones químicas y en la composición de los compuestos. Resolución de cuestiones cuantitativas relacionadas con la química en la vida cotidiana.
FISQ.1.B.2. Clasificación de las reacciones químicas: relaciones que existen entre la química y aspectos importantes de la sociedad actual como, por ejemplo, la conservación del medioambiente o el desarrollo de fármacos.
FISQ.1.B.3. Cálculo de cantidades de materia en sistemas fisicoquímicos concretos, como gases ideales o disoluciones y sus propiedades: variables mesurables propias del estado de los mismos en situaciones de la vida cotidiana.
FISQ.1.B.4. Estequiometría de las reacciones químicas: aplicaciones en los procesos industriales más significativos de la ingeniería química.
C. Química orgánica
FISQ.1.C.1. Propiedades físicas y químicas generales de los compuestos orgánicos a partir de las estructuras químicas de sus grupos funcionales: generalidades en las diferentes series homólogas y aplicaciones en el mundo real.
FISQ.1.C.2. Reglas de la IUPAC para formular y nombrar correctamente algunos compuestos orgánicos mono- y polifuncionales (hidrocarburos, compuestos oxigenados y compuestos nitrogenados).
D. Cinemática
FISQ.1.D.1. Variables cinemáticas en función del tiempo en los distintos movimientos que puede tener un objeto, con o sin fuerzas externas: resolución de situaciones reales relacionadas con la física y el entorno cotidiano.
FISQ.1.D.2. Variables que influyen en un movimiento rectilíneo y circular: magnitudes y unidades empleadas.
Movimientos cotidianos que presentan estos tipos de trayectoria.
FISQ.1.D.3. Relación de la trayectoria de un movimiento compuesto con las magnitudes que lo describen.
E. Estática y dinámica
FISQ.1.E.1. Predicción, a partir de la composición vectorial, del comportamiento estático o dinámico de una partícula y un sólido rígido bajo la acción de un par de fuerzas.
FISQ.1.E.2. Relación de la mecánica vectorial aplicada sobre una partícula o un sólido rígido con su estado de reposo o de movimiento: aplicaciones estáticas o dinámicas de la física en otros campos, como la ingeniería o el deporte.
FISQ.1.E.3. Interpretación de las leyes de la dinámica en términos de magnitudes como el momento lineal y el impulso mecánico: aplicaciones en el mundo real.
F. Energía
FISQ.1.F.1. Conceptos de trabajo y potencia: elaboración de hipótesis sobre el consumo energético de sistemas mecánicos o eléctricos del entorno cotidiano y su rendimiento.
FISQ.1.F.2. Energía potencial y energía cinética de un sistema sencillo: aplicación a la conservación de la energía mecánica en sistemas conservativos y no conservativos y al estudio de las causas que producen el movimiento de los objetos en el mundo real.
FISQ.1.F.3. Variables termodinámicas de un sistema en función de las condiciones: determinación de las variaciones de temperatura que experimenta y las transferencias de energía que se producen con su entorno.
Proyecto de Investigación de Laboratorio 1º Bachillerato
2.- Pictogramas de seguridad.
3.- Material de laboratorio.
4.- Productos de laboratorio. Análisis del etiquetado.
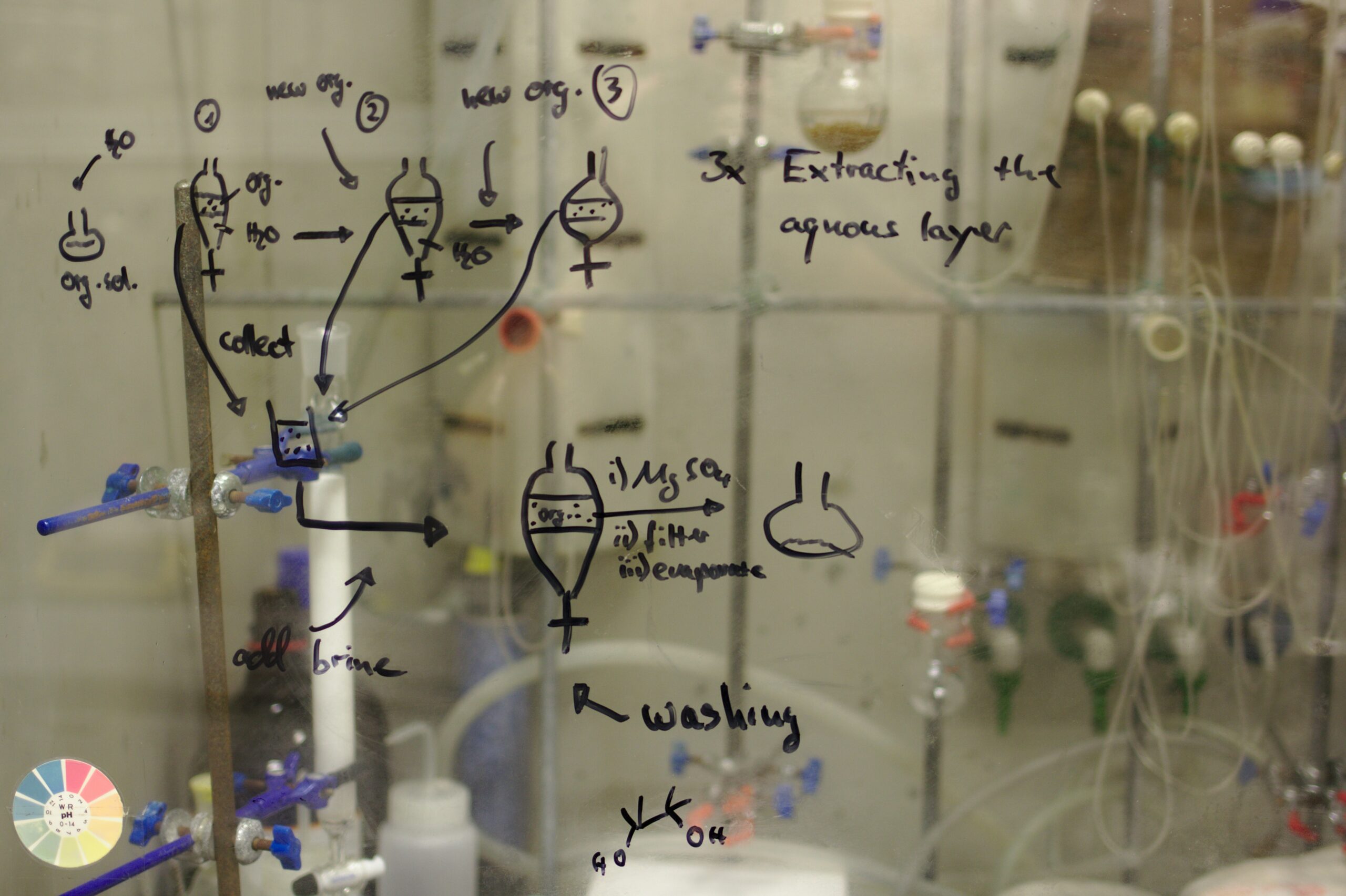
5.- Métodos básicos de separación de mezclas.
6.- Preparación de disoluciones sólido-líquido y líquido-líquido.
7.- Proyecto de divulgación científica. Divulgación del proyecto realizado.
9.- Proyecto de investigación. Búsqueda de información. Experimentación. Recogida de datos. Análisis de los resultados. Elaboración del informe.
10. Reacciones químicas sencillas. Precipitación, neutralización, oxidación.
11. Cristalización.
11. Gravimetrías.
12. Valoraciones ácido base
13. Calorimetrías. Determinación de calores específicos.
14. Determinación del coeficiente de rozamiento estático de distintos materiales y superficies.
15. Cinemática, determinación experimental de la velocidad media y aceleración.
Química 2º Bachillerato
A. Enlace químico y estructura de la materia.
QUIM.2.A.1. Espectros atómicos.
QUIM.2.A.2. Principios cuánticos de la estructura atómica.
QUIM.2.A.3. Tabla periódica y propiedades de los átomos
QUIM.2.A.4. Enlace químico y fuerzas intermoleculares.
B. Reacciones químicas.
QUIM.2.B.1. Termodinámica química.
QUIM.2.B.2. Cinética química. Conceptos de velocidad de reacción. Ley diferencial de la velocidad de una reacción química y los órdenes de reacción a partir de datos experimentales de velocidad de reacción.
QUIM.2.B.3. Equilibrio químico.
QUIM.2.B.4. Reacciones ácido-base.
QUIM.2.B.5. Reacciones redox.
C. Química orgánica.
QUIM.2.C.1. Isomería.
QUIM.2.C.2. Reactividad orgánica.
QUIM.2.C.3. Polímeros.
Para ver los saberes básicos completos relacionados con los bloques de las distintas materias, consultar la orden 14_Orden_Bachillerato_30052023 de Andalucía
Física 2º Bachillerato
A. Campo gravitatorio.
B. Campo electromagnético.
C. Vibraciones y ondas.
D. Física relativista, cuántica, nuclear y de partículas.
Competencias:
Competencias específicas:
Criterios:
Criterios de evaluación:
Física y Química 2º ESO
Competencia específica 1:
1.1. Identificar, comprender y explicar, siguiendo las orientaciones del profesorado, en su entorno próximo, los fenómenos fisicoquímicos cotidianos más relevantes, explicarlos en términos básicos de los principios, teorías y leyes científicas estudiadas y expresarlos con coherencia y corrección, utilizando al menos dos soportes y dos medios de comunicación.
1.2. Resolver los Problemas fisicoquímicos que se le proponen, en situaciones habituales de escasa complejidad, aplicando los aspectos básicos de las leyes y teorías científicas estudia-das, razonando los procedimientos utilizados para encontrar y comprobar la(s) solución(es) obtenidas y expresando adecuadamente los resultados.
1.2. Resolver los problemas fisicoquímicos planteados utilizando las leyes y teorías científicas adecuadas, razonando los procedimientos utilizados para encontrar las soluciones y expresando adecuada mente los resultados.
1.3. Reconocer y describir en el entorno inmediato, siguiendo las orientaciones del profesorado, situaciones problemáticas reales de índole científica y emprender, de forma guiada, iniciativas en las que la ciencia, y en particular la física y la química, pueden contribuir a su solución, reflexionando de forma motivada acerca de su impacto en la sociedad.
Competencia específica 2:
2.1. Aplicar, de forma guiada, las metodologías propias de la ciencia para
identificar y describir fenómenos que suceden en el entorno inmediato a partir de cuestiones a las que se pueda dar respuesta a través de la indagación, la deducción, el trabajo experimental y el razonamiento lógicomatemático, reflexionando de forma argumentada acerca de aquellas pseudocientíficas que no admiten comprobación experimental.
2.2. Seleccionar, de forma guiada, de acuerdo con la naturaleza de las cuestiones que se traten, una manera adecuada de comprobar o refutar las hipótesis formuladas, para diseñar estrategias sencillas de indagación y búsqueda de evidencias que permitan obtener conclusiones y respuestas ajustadas a la naturaleza de la pregunta formulada.
2.2. Seleccionar, de acuerdo con la naturaleza de las cuestiones que se traten, la mejor manera de comprobar o refutar las hipótesis formuladas, para diseñar estrategias de indagación y búsqueda de evidencias que permitan obtener conclusiones y repuestas ajustadas a la naturaleza de la pregunta formulada.
2.3. Aplicar, siguiendo las orientaciones del profesorado, las leyes y teorías científicas estudiadas para formular cuestiones e hipótesis, en situaciones habituales de la realidad, de ma-nera razonada y coherente con el conocimiento científico existente y diseñar, de forma guiada, los procedimientos experimentales o deductivos necesarios para resolverlas.
Competencia específica 3:
3.1. Emplear datos a un nivel básico y en los formatos que se indiquen para interpretar y transmitir información relativa a un proceso fisicoquímico concreto, relacionando entre sí lo que cada uno de ellos contiene, y extrayendo en cada caso, siguiéndolas orientaciones del profesorado, lo más relevante para la resolución de un problema.
3.1. Emplear datos en diferentes formatos para interpretar y comunicar información relativa a un proceso fisicoquímico concreto, relacionando entre sí lo que cada uno de ellos contiene, y extrayendo en cada caso lo más relevante para la resolución de un problema.
3.2. Aplicar adecuadamente las reglas básicas de la física y la química, incluyendo el uso de unidades de medida, las herramientas básicas matemáticas y unas mínimas reglas de nomenclatura, para facilitar una comunicación efectiva con toda la comunidad científica.
3.3. Poner en práctica, de forma responsable y siguiendo las indicaciones del profesorado, las normas de uso de los espacios específicos de la ciencia, como el laboratorio de física y química, como forma de conocer y prevenir los riesgos y de asegurar la salud propia y colectiva, la conservación sostenible del medioambiente y el respeto por las instalaciones.
Competencia específica 4:
4.1. Utilizar al menos dos recursos tradicionales y dos digitales, para el aprendizaje y para participar y colaborar con otros miembros de la comunidad educativa con respeto hacia docentes y estudiantes y reflexionando de forma argumentada acerca de las aportaciones de cada participante.
4.1. Utilizar recursos variados, tradicionales y digitales, mejorando el aprendizaje autónomo y para mejorar la interacción con otros miembros de la comunidad educativa, con respeto hacia docentes y estudiantes y analizando críticamente las aportaciones de cada participante.
4.2. Trabajar de forma adecuada y versátil con al menos dos medios tradicionales y dos digitales, en la consulta de información y la elaboración de contenidos, seleccionando, siguiéndolas orientaciones del profesorado y de forma argumentada, las fuentes más fiables y desechando las menos adecuadas para la mejora del aprendizaje propio y colectivo.
Competencia específica 5:
5.1. Participar en Interacciones constructivas y coeducativas, a través de actividades previamente planificadas de cooperación y del uso de las estrategias propias del trabajo colaborativo, como forma de establecer un medio de trabajo eficiente en la ciencia.
5.1. Establecer Interacciones constructivas y coeducativas, emprendiendo actividades de cooperación y del uso de las estrategias propias del trabajo colaborativo, como forma de construir un medio de trabajo eficiente en la ciencia.
5.2. Emprender, de forma guiada y de acuerdo a la metodología adecuada, proyectos científicos que involucren al alumnado en la mejora de la sociedad andaluza y global y que creen valor para el individuo y para la comunidad.
Competencia específica 6:
6.1. Conocer y apreciar a través del análisis histórico de los hombres y mujeres de ciencia y los avances científicos, que la ciencia es un proceso en permanente construcción y, reconocer las repercusiones mutuas de la ciencia actual con la tecnología, la sociedad y el medioambiente.
6.1. Reconocer y valorar, a través del análisis histórico de los avances científicos logrados por hombres y mujeres de ciencia, que la ciencia es un proceso en permanente construcción, así como reconocer las repercusiones mutuas de la ciencia actual con la tecnología, la sociedad y el medioambiente.
6.2. Identificar, de forma guiada, en el entorno próximo y en situaciones de actualidad las necesidades tecnológicas, ambientales, económicas y sociales más importantes que demanda la sociedad para reconocer la capacidad de la ciencia para darles solución sostenible a través de la implicación de todos los ciudadanos.
Física y Química 3º ESO
Competencia específica 1
1.1. Identificar, comprender y explicar los fenómenos fisicoquímicos cotidianos más relevantes, a partir de los principios, teorías y leyes científicas adecuadas, expresándolos, de manera argumentada, utilizando diversidad de soportes y medios de comunicación.
1.2. Resolver los problemas fisicoquímicos planteados utilizando las leyes y teorías científicas adecuadas, razonando los procedimientos utilizados para encontrar las soluciones y expresando adecuadamente los resultados.
1.3. Reconocer y describir en el entorno inmediato situaciones problemáticas reales de índole científica y emprender iniciativas en las que la ciencia, y en particular la física y la química, pueden contribuir a su solución, analizando críticamente su impacto en la sociedad.
Competencia específica 2
2.1. Emplear las metodologías propias de la ciencia para identificar y describir fenómenos a partir de cuestiones a las que se pueda dar respuesta a través de la indagación, la deducción, el trabajo experimental y el razonamiento lógico-matemático, diferenciándolas de aquellas pseudocientíficas que no admiten comprobación experimental.
2.2. Seleccionar, de acuerdo con la naturaleza de las cuestiones que se traten, la mejor manera de comprobar o refutar las hipótesis formuladas, para diseñar estrategias de indagación y búsqueda de evidencias que permitan obtener conclusiones y repuestas ajustadas a la naturaleza de la pregunta formulada.
2.3. Aplicar las leyes y teorías científicas conocidas para formular cuestiones e hipótesis, de manera informada y coherente con el conocimiento científico existente y diseñar los procedimientos experimentales o deductivos necesarios para resolverlas o comprobarlas.
Competencia específica 3
3.1. Emplear datos en diferentes formatos para interpretar y comunicar información relativa a un proceso fisicoquímico concreto, relacionando entre sí lo que cada uno de ellos contiene, y extrayendo en cada caso lo más relevante para la resolución de un problema.
3.2. Utilizar adecuadamente las reglas básicas de la física y la química, incluyendo el uso de unidades de medida, las herramientas matemáticas y las reglas de nomenclatura, consiguiendo una comunicación efectiva con toda la comunidad científica.
3.3. Poner en práctica las normas de uso de los espacios específicos de la ciencia, como el laboratorio de física y química, como medio de asegurar la salud propia y colectiva, la conservación sostenible del medioambiente y el cuidado de las instalaciones.
Competencia específica 4
4.1. Utilizar recursos variados, tradicionales y digitales, mejorando el aprendizaje autónomo y para mejorar la interacción con otros miembros de la comunidad educativa, con respeto hacia docentes y estudiantes y analizando críticamente las aportaciones de cada participante.
4.2. Trabajar de forma adecuada y versátil con medios variados, tradicionales y digitales, en la consulta de información y la creación de contenidos, seleccionando con criterio las fuentes más fiables y desechando las menos adecuadas para la mejora del aprendizaje propio y colectivo.
Competencia específica 5
5.1. Establecer interacciones constructivas y coeducativas, emprendiendo actividades de cooperación y del uso de las estrategias propias del trabajo colaborativo, como forma de construir un medio de trabajo eficiente en la ciencia.
5.2. Emprender, de forma guiada y de acuerdo a la metodología adecuada, proyectos científicos que involucren al alumnado en la mejora de la sociedad y que creen valor para el individuo y para la comunidad, tanto local como globalmente.
Competencia específica 6
6.1. Reconocer y valorar, a través del análisis histórico de los avances científicos logrados por hombres y mujeres de ciencia y los avances científicos, que la ciencia es un proceso en permanente construcción y las repercusiones mutuas de la ciencia actual con la tecnología, la sociedad y el medioambiente.
6.2. Detectar en el entorno las necesidades tecnológicas, ambientales, económicas y sociales más importantes que demanda la sociedad, entendiendo la capacidad de la ciencia para darles solución sostenible a través de la implicación de todos los ciudadanos.
Física y Química 4º ESO
Competencia específica 1:
1.1. Comprender y explicar con rigor los fenómenos fisicoquímicos cotidianos a partir de los principios, teorías y leyes científicas adecuadas, expresándolos de manera argumentada, utilizando diversidad de soportes y medios de comunicación.
1.2. Resolver problemas fisicoquímicos mediante las leyes y teorías científicas adecuadas, razonando los procedimientos utilizados para encontrar las soluciones y expresando adecuadamente los resultados con corrección y precisión.
1.3. Reconocer y describir situaciones problemáticas reales de índole científica y emprender iniciativas colaborativas en las que la ciencia, y en particular la física y la química, pueden contribuir a su solución, analizando críticamente su impacto en la sociedad y en el medioambiente.
Competencia específica 2:
2.1. Emplear las metodologías propias de la ciencia para identificar y describir fenómenos científicos a partir de situaciones tanto observadas en el mundo natural como planteadas a través de enunciados con información textual, gráfica o numérica.
2.2. Predecir, para las cuestiones planteadas, respuestas que se puedan comprobar con las herramientas y conocimientos adquiridos, tanto de forma experimental como deductiva, aplicando el razonamiento lógico-matemático en su proceso de validación.
2.3. Aplicar las leyes y teorías científicas más importantes para validar hipótesis, de manera informada y coherente con el conocimiento científico existente, diseñando los procedimientos experimentales o deductivos necesarios para resolverlas y analizan los resultados críticamente.
Competencia específica 3:
3.1. Emplear fuentes variadas, fiables y seguras para seleccionar, interpretar. organizar y comunicar información relativa a un proceso fisicoquímico concreto, relacionando entre sí lo que cada una de ellas contiene, extrayendo en cada caso lo más relevante para la resolución de un problema y desechando todo lo que sea irrelevante.
3.2. Utilizar adecuadamente las reglas básicas de la física y la química, incluyendo el uso correcto de varios sistemas de unidades, las herramientas matemáticas necesarias y las re-glas de nomenclatura avanzadas, para facilitar una comunicación efectiva con toda la comunidad científica.
3.3. Aplicar con rigor las normas de uso de los espacios específicos de la ciencia, como el laboratorio de física y química, como medio de asegurar la salud propia y colectiva, la conservación sostenible del medioambiente y el respeto por las instalaciones.
Competencia específica 4:
4.1. Utilizar de forma eficiente recursos variados, tradicionales
y digitales, para mejorar el aprendizaje autónomo y la interacción con otros miembros de la comunidad educativa, de forma rigurosa y respetuosa y analizando críticamente las aportaciones de cada participante.
4.2. Trabajar de forma versátil con medios variados, tradicionales y digitales, en la consulta de información y la creación de contenidos, seleccionando y empleando con criterio las fuentes y herramientas más fiables y desechando las menos adecuadas para la mejora del aprendizaje propio y colectivo.
Competencia específica 5:
5.1. Establecer interacciones constructivas y coeducativas emprendiendo actividades de cooperación e iniciando el uso de las estrategias propias del trabajo colaborativo, como forma de construir un medio de trabajo eficiente en la ciencia.
5.2. Emprender, de forma autónoma y de acuerdo a la metodología adecuada, proyectos científicos que involucren al alumnado en la mejora de la sociedad andaluza y global y que creen valor tanto para el individuo como para la comunidad.
Competencia específica 6:
6.1. Reconocer y valorar, a través del análisis histórico de los avances científicos logrados por mujeres y hombres y de situaciones y contextos actuales (líneas de investigación, instituciones científicas y hombres y mujeres en ellas, aplicaciones directas), que la ciencia es un proceso en permanente construcción y que esta tiene repercusiones e implicaciones importantes en la sociedad actual.
6.2. Detectar las necesidades tecnológicas, ambientales, económicas y sociales más importantes que demanda la sociedad para entender la capacidad de la ciencia para darles solución sostenible a través de la implicación de toda la ciudadanía.
Ámbito Científico Tecnológico DIVER 4º ESO
Competencia específica 1:
1.1. Reconocer situaciones susceptibles de ser formuladas y resueltas mediante herramientas y estrategias matemáticas, planteando variantes, modificando alguno de sus datos o alguna condición del problema y proporcionando una representación matemática adecuada.
1.2. Comprobar la validez de las soluciones a un problema desde un punto de vista lógico-matemático, verbalizando de forma clara y concisa el procedimiento se-guido, y elaborar las respuestas evaluando su alcance, repercusión y coherencia en su contexto.
Competencia específica 2:
2.1. Reconocer y usar las relaciones entre los conocimientos y experiencias matemáticas formando un todo coherente, reconociendo y utilizando las conexiones entre ideas matemáticas en la resolución de problemas.
2.2. Realizar conexiones entre diferentes procesos matemáticos aplicando conocimientos y experiencias, enlazando las nuevas ideas matemáticas con ideas previas.
Competencia específica 3:
3.1. Establecer conexiones entre el mundo real y las matemáticas usando los procesos inherentes a la investigación científica y matemática: inferir, medir, comunicar, clasificar y predecir, aplicando distintos procedimientos en la resolución de problemas en situaciones di-versas.
3.2. Analizar conexiones coherentes en el entorno próximo, entre las necesidades tecnológicas, ambientales, económicas y sociales más importantes que demanda la sociedad para reconocer la capacidad de la ciencia para darle solución a situaciones de la vida cotidiana.
3.3. Reconocer en diferentes contextos (personal, escolar, social, científico y humanístico), cómo a lo largo de la historia, la ciencia ha mostrado un proceso constructivo permanente y su aportación al progreso de la humanidad debido a su interacción con la tecnología, la sociedad y el medioambiente.
Competencia específica 4:
4.1. Gestionar las emociones propias y desarrollar el autoconcepto matemático como herramienta, generando expectativas positivas ante nuevos retos, pensando de forma crítica y creativa, adaptándose ante la incertidumbre y reconociendo fuentes de estrés.
4.2. Mostrar una actitud positiva, proactiva y perseverante, aceptando la crítica razonada, el error y las conclusiones de las autoevaluaciones como elementos necesarios para hacer frente a las diferentes situaciones de aprendizaje
Competencia específica 5:
5.1. Interpretar el paisaje analizando el origen, relación y evolución integrada de sus elementos, entendiendo los procesos geológicos que lo han formado y los fundamentos que determinan su dinámica.
5.2. Analizar los elementos del paisaje, determinando de forma crítica el valor de sus recursos, e impacto ambiental y los riesgos naturales derivados de determinadas acciones humanas pasadas, presentes y futuras.
Competencia específica 6:
6.1. Interpretar y comprender problemas matemáticos complejos de la vida cotidiana y fenómenos fisicoquímicos, organizando y analizando los datos dados, estableciendo relaciones entre ellos, comprendiendo las preguntas formuladas y explicarlos en términos básicos de los principios, teorías y leyes científicas.
6.2. Expresar problemas
matemáticos complejos o fenómenos fisicoquímicos, con coherencia y corrección utilizan-do a menos dos soportes y dos medios de comunicación, elaborando representaciones matemáticas utilizando herramientas de interpretación y modelización como expresiones simbólicas o gráficas.
6.3. Reconocer y describir en el entorno inmediato situaciones problemáticas reales de índole científica de diversa complejidad y emprender iniciativas que puedan contribuir a su so-lución, aplicando herramientas y estrategias apropiadas de las matemáticas y las ciencias, buscando un impacto en la sociedad.
6.4. Resolver problemas matemáticos y fisicoquímicos de diversa complejidad movilizando los conocimientos necesarios, aplicando las teorías y leyes científicas, razonando los procedimientos, expresando adecuadamente los resultados y aceptando el error como parte del proceso.
Competencia específica 7:
7.1. Analizar preguntas e hipótesis que puedan ser respondidas o contrastadas, a través de la indagación, la deducción, el trabajo experimental y el razonamiento lógico-matemático, utilizando métodos científicos, intentando explicar fenómenos del entorno cercano, y realizar predicciones sobre estos.
7.2. Estructurar los procedimientos experimentales o deductivos, la toma de datos y el análisis de fenómenos del entorno cercano, seleccionando estrategias sencillas de indagación, para obtener conclusiones y respuestas aplicando las leyes y teoría científicas estudiadas, de modo que permitan responder a preguntas concretas y contrastar una hipótesis planteada.
7.3. Reproducir experimentos, de manera autónoma, cooperativa e igualitaria y tomar datos cuantitativos o cualitativos, sobre fenómenos del entorno cercano, utilizando los instrumentos, herramientas o técnicas adecuadas en condiciones de seguridad.
7.4. Analizar los resultados obtenidos en el proyecto de investigación utilizando, cuando sea necesario, herramientas matemáticas (tablas de datos, representaciones gráficas), tecnológicas (conversores, calculadoras, creadores gráficos) y el razonamiento inductivo para formular argumentos matemáticos, analizando patrones, propiedades y relaciones.
7.5. Cooperar dentro de un proyecto científico, asumiendo responsablemente una función concreta, respetando la diversidad y la igualdad de género, y favoreciéndola inclusión.
7.6. Presentación de la información y las conclusiones obtenidas mediante la experimentación y observación de campo utilizando el formato adecuado (tablas, gráficos, informes, fotografías, pósters) y, cuando sea necesario, herramientas digitales (infografías, presentaciones, editores de vídeos y similares).
Competencia específica 8:
7.7. Exponer la contribución de la ciencia a la sociedad y la labor de personas dedicadas a ella, destacando el papel de la mujer, fomentando vocaciones científicas desde una perspectiva de género, y entendiendo la investigación como una labor colectiva e interdisciplinar en constante evolución, reflexionando de forma argumentada acerca de aquellas pseudocientíficas que no admiten comprobación experimental.
Competencia específica 8:
8.1. Resolver problemas cotidianos complejos o dar explicación a procesos naturales, trabajando la abstracción para determinar los aspectos más relevantes, utilizando conocimientos, organizando datos e información aportados a través del razonamiento lógico, el pensamiento computacional o recursos digitales.
8.2. Modelizar situaciones de la vida cotidiana y resolver problemas sencillos sobre fenómenos biológicos y geológicos, utilizando datos, algoritmos y fuentes contrastadas.
Competencia específica 9:
9.1. Analizar conceptos y procesos relacionados con los saberes de Biología y Geología, Física y Química y Matemáticas, interpretando información en diferentes formatos (modelos, gráficos, tablas, diagramas, fórmulas, esquemas, símbolos, páginas web, etc.), manteniendo una actitud crítica, obteniendo conclusiones fundamentadas y usando adecuadamente los datos para la resolución de un problema.
9.2. Facilitar la comprensión y análisis de información relacionada con los saberes de la materia de Biología y Geología, Física y Química y Matemáticas, transmitiéndola de forma clara utilizando la terminología, lenguaje y el formato adecuados (modelos, gráficos, tablas, vídeos, informes, diagramas, fórmulas, esquemas, símbolos, contenidos digitales, etc.).
9.3. Analizar y explicar fenómenos biológicos y geológicos representándolos mediante modelos y diagramas y utilizando, cuando sea necesario, los pasos del diseño de ingeniería (identificaión del problema, exploración, diseño, creación, evaluación y mejora), incluyen-do el uso de unidades de medida, las herramientas matemáticas y las reglas de nomenclatura, para facilitar una comunicación efectiva con toda la comunidad científica.
9.4. Poner en práctica las normas de uso de los espacios específicos de la ciencia, como el laboratorio, como medio de asegurar la salud propia y colectiva, la conservación sostenible del medio ambiente y el respeto por las instalaciones.
Competencia específica 10:
10.1. Utilizar recursos variados, tradicionales y digitales, para el correcto trabajo autónomo y cooperativo de saberes científicos, seleccionando, analizando críticamente y representan-do información, mediante el uso distintas fuentes, con respeto y reflexión de las aportaciones de cada participante.
10.2. Trabajar de forma adecuada y versátil con medios variados, tradicionales y digitales, la consulta de información y la creación de contenidos distinguiendo la que tiene un origen científico de las pseudociencias o bulos.
Competencia específica 11:
11.1. Relacionar con fundamentos científicos la preservación de la biodiversidad, la conservación del medio ambiente, la protección de los seres vivos del entorno, el desarrollo sostenible y la calidad de vida, comprendiendo la repercusión global de actuaciones locales.
11.2. Proponer y adoptar hábitos sostenibles y saludables analizando de una manera crítica las actividades propias y ajenas, valorando su impacto global y basándose en los propios razonamientos, conocimientos adquiridos e información de diversas fuentes, precisa y fiable disponible, de mane-ra que el alumnado pueda emprender, de forma guiada y de acuerdo a la metodología adecuada, proyectos científicos que lo involucren en la mejora de la sociedad, con actitud crítica, desterrando ideas preconcebidas y estereotipos sexistas a través de actividades de cooperación y del uso de las estrategias propias del trabajo colaborativo, como forma de construir un medio de trabajo eficiente en la ciencia.
11.3. Colaborar activamente y construir relaciones saludables en el trabajo en equipos heterogéneos, aportando valor, favoreciendo la inclusión, ejercitando la escucha activa, mostrando empatía por los demás, respetando diferentes opiniones, comunicándose de manera efectiva y empática, planificando e indagando con motivación y confianza en sus propias posibilidades, pensando de forma crítica y creativa y tomando decisiones y juicios informa-dos, aportando valor al equipo.
Proyecto de Investigación de Laboratorio 1º Bachillerato
2.- Cumplir y respetar las normas de seguridad e higiene del laboratorio.
3.- Contrastar algunas hipótesis basándose en la experimentación, recopilación de datos y análisis de resultados.
4.- Aplicar las técnicas y el instrumental apropiado para identificar magnitudes.
5.- Preparar disoluciones de diversa índole, utilizando estrategias prácticas. 6.- Separar los componentes de una mezcla utilizando las técnicas instrumentales apropiadas.
7.- Reconocer e identificar las características del método científico.
8. Valorar la investigación científica y su impacto en la industria y en el desarrollo de la sociedad.
9.- Utilizar adecuadamente las TIC en la búsqueda, selección y proceso de la información encaminadas a la investigación o estudio que relacione el conocimiento cien-tífico.
11.- Presentar los resultados de los proyectos realizados utilizando las TIC. Confeccionar los informes correspondientes.
12.- Exponer oralmente los trabajos realizados.
13.- Identificar situaciones problemáticas en el entorno cotidiano, emprender iniciativas y buscar soluciones sostenibles desde la física y la química, analizando críticamente el impacto producido en la sociedad y el medioambiente.
14.- Resolver problemas fisico-químicos planteados a partir de situaciones cotidianas, aplicando las leyes y teorías científicas para encontrar y argumentar las soluciones, expresando adecuadamente los resultados.
15.- Formular y verificar hipótesis como respuestas a diferentes problemas y observaciones, manejando con soltura el trabajo experimental, la indagación, la búsqueda de evidencias y el razonamiento lógico-matemático.
16.- Formular y verificar hipótesis como respuestas a diferentes problemas y observaciones, manejando con soltura el trabajo experimental, la indagación, la búsqueda de evidencias y el razonamiento lógico-matemático.
17.- Integrar las leyes y teorías científicas conocidas en el desarrollo del procedimiento de la validación de las hipótesis formuladas, aplicando relaciones cualitativas y cuantitativas entre las diferentes variables, de manera que el proceso sea más fiable y coherente con el conocimiento científico adquirido.
18.- Utilizar y relacionar de manera rigurosa diferentes sistemas de unidades, empleando correctamente su notación y sus equivalencias, haciendo posible una comunicación efectiva con toda la comunidad científica.
20.- Emplear diferentes formatos para interpretar y expresar información relativa a un proceso fisico-químico concreto, relacionando entre sí la información que cada uno de ellos contiene y extrayendo de él lo más relevante durante la resolución de un problema.
21.- Poner en práctica los conocimientos adquiridos en la experimentación científica en laboratorio o campo, incluyendo el conocimiento de sus materiales y su normativa básica de uso, así como de las normas de seguridad propias de estos espacios, y comprendiendo la importancia en el progreso científico y emprendedor de que la experimentación sea se-gura, sin comprometer la integridad física propia ni colectiva.
22.- Interactuar con otros miembros de la comunidad educativa a través de diferentes en-tornos de aprendizaje, reales y virtuales, utilizando de forma autónoma y eficiente recursos variados, tradicionales y digitales, con rigor y respeto y analizando críticamente las aportaciones de todo el mundo.
23.- Trabajar de forma autónoma y versátil, individualmente y en equipo, en la consulta de información y la creación de contenidos, utilizando con criterio las fuentes y herramientas más fiables, y desechando las menos adecuadas, mejorando así el aprendizaje propio y colectivo.
24.- Participar de manera activa en la construcción del conocimiento científico, evidenciando la presencia de la interacción, la cooperación y la evaluación entre iguales, mejorando el cuestionamiento, la reflexión y el debate al alcanzar el consenso en la resolución de un problema o situación de aprendizaje.
25.- Construir y producir conocimientos a través del trabajo colectivo, además de ex-plorar alternativas para superar la asimilación de conocimientos ya elaborados y encontrando momentos para el análisis, la discusión y la síntesis, obteniendo como resultado la elaboración de productos representados en informes, pósteres, presentaciones, artículos, etc.
26.- Debatir, de manera informada y argumentada, sobre las diferentes cuestiones medioambientales, sociales y éticas relacionadas con el desarrollo de las ciencias, alcan-zando un consenso sobre las consecuencias de estos avances y proponiendo soluciones creativas en común a las cuestiones planteadas.
Física y Química 1º Bachillerato
Competencia específica 1
1.1. Aplicar las leyes y teorías científicas en el análisis de fenómenos fisicoquímicos cotidianos, comprendiendo las causas que los producen y explicándolas utilizando diversidad de soportes y medios de comunicación.
1.2. Resolver problemas fisicoquímicos planteados a partir de situaciones cotidianas, aplicando las leyes y teorías científicas para encontrar y argumentar las soluciones, expresando adecuadamente los resultados.
1.3. Identificar situaciones problemáticas en el entorno cotidiano, emprender iniciativas y buscar soluciones sostenibles desde la física y la química, analizando críticamente el impacto producido en la sociedad y el medioambiente.
Competencia específica 2
2.1. Formular y verificar hipótesis como respuestas a diferentes problemas y observaciones, manejando con soltura el trabajo experimental, la indagación, la búsqueda de evidencias y el razonamiento lógico-matemático.
2.2. Utilizar diferentes métodos para encontrar la respuesta a una sola cuestión u observación, cotejando los resultados obtenidos por diferentes métodos y asegurándose así de su coherencia y fiabilidad.
2.3. Integrar las leyes y teorías científicas conocidas en el desarrollo del procedimiento de la validación de las hipótesis formuladas, aplicando relaciones cualitativas y cuantitativas entre las diferentes variables, de manera que el proceso sea más fiable y coherente con el conocimiento científico adquirido.
Competencia específica 3
3.1. Utilizar y relacionar de manera rigurosa diferentes sistemas de unidades, empleando correctamente su notación y sus equivalencias, haciendo posible una comunicación efectiva con toda la comunidad científica.
3.2. Nombrar y formular correctamente sustancias simples, iones y compuestos químicos inorgánicos y orgánicos utilizando las normas de la IUPAC, como parte de un lenguaje integrador y universal para toda la comunidad científica.
3.3. Emplear diferentes formatos para interpretar y expresar información relativa a un pro-ceso fisicoquímico concreto, relacionando entre sí la información que cada uno de ellos contiene y extrayendo de él lo más relevante durante la resolución de un problema.
3.4. Poner en práctica los conocimientos adquiridos en la experimentación científica en laboratorio o campo, incluyendo el conocimiento de sus materiales y su normativa básica de uso, así como de las normas de seguridad propias de estos espacios, y comprendiendo la importancia en el progreso científico y emprendedor de que la experimentación sea segura, sin comprometer la integridad física propia ni colectiva.
Competencia específica 4
4.1. Interactuar con otros miembros de la comunidad educativa a través de diferentes entornos de aprendizaje, reales y virtuales, utilizando de forma autónoma y eficiente recursos variados, tradicionales y digitales, con rigor y respeto y analizando críticamente las aportaciones de todo el mundo.
4.2. Trabajar de forma autónoma y versátil, individualmente y en equipo, en la consulta de información y la creación de contenidos, utilizando con criterio las fuentes y herramientas más fiables, y desechando las menos adecuadas, mejorando así el aprendizaje propio y colectivo.
Competencia específica 5
5.1. Participar de manera activa en la construcción del conocimiento científico, evidencian-do la presencia de la interacción, la cooperación y la evaluación entre iguales, mejorando el cuestionamiento, la reflexión y el debate al alcanzar el consenso en la resolución de un problema o situación de aprendizaje.
5.2. Construir y producir conocimientos a través del trabajo colectivo, además de explorar alternativas para superar la asimilación de conocimientos ya elaborados y encontrando momentos para el análisis, la discusión y la síntesis, obteniendo como resultado la elaboración de productos representados en informes, pósteres, presentaciones, artículos, etc.
5.3. Debatir, de manera informada y argumentada, sobre las diferentes cuestiones medioambientales, sociales y éticas relacionadas con el desarrollo de las ciencias, alcanzando un consenso sobre las consecuencias de estos avances y proponiendo soluciones creativas en común a las cuestiones planteadas.
Competencia específica 6
6.1. Identificar y argumentar científicamente las repercusiones de las acciones que el alumno o alumna emprende en su vida cotidiana, analizando cómo mejorarlas como forma de participar activamente en la construcción de una sociedad mejor.
6.2. Detectar las necesidades de la sociedad sobre las que aplicar los conocimientos científicos adecuados que ayuden a mejorarla, incidiendo especialmente en aspectos importantes como la resolución de los grandes retos ambientales, el desarrollo sostenible y la promoción de la salud.
Física 2º Bachillerato
Competencia específica1:
1.1. Reconocer la relevancia de la Física en el desarrollo de la ciencia, la tecnología, la economía, la sociedad y la sostenibilidad ambiental, empleando adecuadamente los fundamentos científicos relativos a esos ámbitos.
1.2. Resolver problemas de manera experimental y analítica, utilizando principios, leyes y teorías de la Física.
Competencia específica 2:
2.1. Analizar y comprender la evolución de los sistemas naturales, utilizando modelos, le-yes y teorías de la Física.
2.2. Inferir soluciones generales a problemas generales a partir del análisis de situaciones particulares y las variables de que dependen.
2.3. Conocer aplicaciones prácticas y productos útiles para la sociedad en el campo tecnológico, industrial y biosanitario, analizándolos de acuerdo con los modelos, las leyes y las teorías de la Física.
Competencia específica 3:
3.1. Aplicar los principios, leyes y teorías científicas en el análisis crítico de procesos físicos del entorno, como los observados y los publicados en distintos medios de comunicación, analizando, comprendiendo y explicando las causas que los producen.
3.2. Utilizar de manera rigurosa las unidades de las variables físicas en diferentes sistemas de unidades, empleando correctamente su notación y sus equivalencias, así como la elaboración e interpretación adecuada de gráficas que relacionan variables físicas, posibilitando una comunicación efectiva con toda la comunidad científica.
3.3. Expresar de forma adecuada los resultados, argumentando las soluciones obtenidas, en la resolución de los ejercicios y problemas que se plantean, bien sea a través de situaciones reales o ideales.
Competencia específica 4:
4.1. Consultar, elaborar e intercambiar materiales científicos y divulgativos en distintos formatos con otros miembros del entorno de aprendizaje, utilizando de forma autónoma y eficiente plataformas digitales.
4.2. Usar de forma crítica, ética y responsable medios de comunicación digitales y tradicionales como modo de enriquecer el aprendizaje y el trabajo individual y colectivo.
Competencia específica 5:
5.1. Obtener relaciones entre variables físicas, midiendo y tratando los datos experimenta-les, determinando los errores y utilizando sistemas de representación gráfica.
5.2. Reproducir en laboratorios, sean reales o virtuales, determinados procesos físicos, modificando las variables que los condicionan, considerando los principios, leyes o teorías implicados, generando el correspondiente informe con formato adecuado e incluyendo argumentaciones, conclusiones, tablas de datos, gráficas y referencias bibliográficas.
5.3. Valorar la Física, debatiendo de forma fundamentada sobre sus avances y la implicación en la sociedad desde el punto de vista de la ética y de la sostenibilidad.
Competencia específica 6:
6.1. Identificar los principales avances científicos relacionados con la Física que han contribuido a la formulación de las leyes y teorías aceptadas actualmente en el conjunto de las
disciplinas científicas, como las fases para el entendimiento de las metodologías de la ciencia, su evolución constante y su universalidad.
6.2. Reconocer el carácter multidisciplinar de la ciencia y las contribuciones de unas disciplinas en otras, estableciendo relaciones entre la Física y la Química, la Biología, la Geología o las Matemáticas.
Química 2º Bachillerato
Competencia específica 1:
1.1. Reconocer la importancia de la Química y sus conexiones con otras áreas en el desarrollo de la sociedad, el progreso de la ciencia, la tecnología, la economía y el desarrollo y sostenible respetuoso con el medioambiente, identificando los avances en el campo de la Química que han sido fundamentales en estos aspectos.
1.2. Describir los principales procesos químicos que suceden en el entorno y las propiedades de los sistemas materiales a partir de los conocimientos, destrezas y actitudes propios de las distintas disciplinas de la Química.
1.3. Reconocer la naturaleza experimental e interdisciplinar de la Química y su influencia en la investigación científica y en los ámbitos económico y laboral actuales, considerando los hechos empíricos y sus aplicaciones en otros campos del conocimiento y la actividad humana.
Competencia específica 2:
2.1. Relacionar los principios de la Química con los principales problemas de la actualidad asociados al desarrollo de la ciencia y la tecnología, analizando cómo se comunican a través de los medios de comunicación o son observados en la experiencia cotidiana.
2.2. Reconocer y comunicar que las bases de la Química constituyen un cuerpo de conocimiento imprescindible en un marco contextual de estudio y discusión de cuestiones significativas en los ámbitos social, económico, político y ético, identificando la presencia e in-fluencia de estas bases en dichos ámbitos.
2.3. Aplicar de manera informada, coherente y razonada los modelos y leyes de la Química, explicando y prediciendo las consecuencias de experimentos, fenómenos naturales, procesos industriales y descubrimientos científicos.
Competencia específica 3:
3.1. Utilizar correctamente las normas de nomenclatura de la IUPAC como base de un len-guaje universal para la Química que permita una comunicación efectiva en toda la comunidad científica, aplicando dichas normas al reconocimiento y escritura de fórmulas y nombres de diferentes especies químicas.
3.2. Emplear con rigor herramientas matemáticas para apoyar el desarrollo del pensamiento científico que se alcanza con el estudio de la Química, aplicando estas herramientas en la resolución de problemas usando ecuaciones, unidades, operaciones, etc.
3.3. Practicar y hacer respetar las normas de seguridad relacionadas con la manipulación de sustancias químicas en el laboratorio y en otros entornos, así como los procedimientos para la correcta gestión y eliminación de los residuos, utilizando correctamente los códigos de comunicación característicos de la Química.
Competencia específica 4:
4.1. Analizar la composición química de los sistemas materiales que se encuentran en el entorno más próximo, en el medio natural y en el entorno industrial y tecnológico, demostrando que sus propiedades, aplicaciones y beneficios están basados en los principios de la Química.
4.2. Argumentar de manera informada, aplicando las teorías y leyes de la Química, que los efectos negativos de determinadas sustancias en el ambiente y en la salud se deben al mal uso que se hace de esos productos o negligencia, y no a la ciencia química en sí.
4.3. Explicar, empleando los conocimientos científicos adecuados, cuáles son los beneficios de los numerosos productos de la tecnología química y cómo su empleo y aplicación han contribuido al progreso de la sociedad.
Competencia específica 5:
5.1. Reconocer la importante contribución en la Química del trabajo colaborativo entre especialistas de diferentes disciplinas científicas poniendo de relieve las conexiones entre las leyes y teorías propias de cada una de ellas.
5.2. Reconocer la aportación de la Química al desarrollo del pensamiento científico y a la autonomía de pensamiento crítico a través de la puesta en práctica de las metodologías de trabajo propias de las disciplinas científicas.
5.3. Resolver problemas relacionados con la Química y estudiar situaciones relacionadas con esta ciencia, reconociendo la importancia de la contribución particular de cada miembro del equipo y la diversidad de pensamiento y consolidando habilidades sociales positivas en el seno de equipos de trabajo.
5.4. Representar y visualizar de forma eficiente los conceptos de Química que presenten mayores dificultades utilizando herramientas digitales y recursos variados, incluyendo experiencias de laboratorio real y virtual.
Competencia específica 6:
6.1. Explicar y razonar los conceptos fundamentales que se encuentran en la base de la Química aplicando los conceptos, leyes y teorías de otras disciplinas científicas (especial-mente de la física) a través de la experimentación y la indagación.
6.2. Deducir las ideas fundamentales de otras disciplinas científicas (por ejemplo, la biología o la tecnología) por medio de la relación entre sus contenidos básicos y las leyes y teorías que son propias de la Química.
6.3. Solucionar problemas y cuestiones que son característicos de la Química utilizando las herramientas provistas por las matemáticas y la tecnología, reconociendo así la relación entre los fenómenos experimentales y naturales y los conceptos propios de esta disciplina.
Evaluación:
Criterios de evaluación:
Evaluación
De conformidad con lo dispuesto en el artículo 10.1 de la Orden de 30 de mayo de 2023, «La evaluación del proceso de aprendizaje del alumnado será continua, competencial, formativa, integradora, diferenciada y objetiva según las distintas materias del currículo y será un instrumento para la mejora tanto de los procesos de enseñanza como de los procesos de aprendizaje. Tomará como referentes los criterios de evaluación de las diferentes materias curriculares, a través de los cuales se medirá el grado de consecución de las competencias específicas.»
De acuerdo con lo dispuesto en el artículo 11.1 de la Orden de 30 de mayo de 2023,«El profesorado llevará a cabo la evaluación, preferentemente, a través de la observación continuada de la evolución del proceso de aprendizaje en relación con los criterios de evaluación y el grado de desarrollo de las competencias específicas de cada materia.».
Asimismo en el artículo 11.4 de la citada ley: «Para la evaluación del alumnado se utilizarán diferentes instrumentos tales como cuestionarios, formularios, presentaciones, exposiciones orales, edición de documentos, pruebas, escalas de observación, rúbricas o portfolios, entre otros, coherentes con los criterios de evaluación y con las características específicas del alumnado, garantizando así que la evaluación responde al principio de atención a la diversidad y a las diferencias individuales. Se fomentarán los procesos de coevaluación, evaluación entre iguales, así como la autoevaluación del alumnado, potenciando la capacidad del mismo para juzgar sus logros respecto a una tarea determinada.».
Según lo dispuesto en el artículo 13.6 del Decreto 102/2023 , de 9 de mayo, «El profesorado evaluará tanto los aprendizajes del alumnado como los procesos de enseñanza y su propia práctica docente.»
La calificación de la materia se calculará haciendo la media de las calificaciones de las Competencias Específicas, las cuales a su vez se obtienen haciendo la media de las calificaciones de los Criterios de Evaluación de cada Competencia Específica.
Normas Laboratorio
Normas de uso del laboratorio de Física y Química
Normas de organización del Laboratorio
- El profesor/a te asignará un grupo de trabajo y una mesa.
- Atiende al profesor/a.
- Trabajaremos en silencio: cada grupo se responsabilizará de su zona de trabajo y de su material.
- Si es necesario desplazarse, lo haremos tranquilamente, sin carreras.
- No se molestará a los demás compañeros, el laboratorio es un lugar para trabajar con seriedad.
- Sobre la mesa solo deben hallarse los materiales que vallamos a utilizar. La ropa de abrigo y el material deben colocarse bajo las mesas.
- Al comenzar una actividad debes tener todo el material preparado.
- No toques ni juegues con ningún material que no corresponda a la práctica.
- Utiliza el cuaderno de prácticas para para anotar qué hacemos: medidas, resultados, dibujos…..
- Al finalizar desconecta los aparatos eléctricos.
- A la salida los taburetes quedarán sobre las mesas.
Normas de seguridad en el Laboratorio
- No cojas ningún producto químico, tu profesor o profesora te lo proporcionará. Los reactivos hay que manejarlos con cuidado.
- No toques nunca los reactivos con las manos y mantén cerrados los recipientes.
- Si usamos ácidos, cuando queramos diluirlos NUNCA echaremos agua sobre los ácidos, siempre al contrario, es decir, se vierte el ácido sobre el agua.
- Ten precaución al oler: con tu mano lleva los vapores hacia tu nariz, y no la nariz a los vapores.
- Los productos químicos nunca han de probarse para conocer su sabor.
- Los mecheros y grifos estarán abiertos solo cuando sea necesario.
- No mover los mecheros mientras están encendidos.
- Los mecheros encendidos han de estar siempre vigilados por una persona.
- La ropa suelta y el pelo largo son candidatos a chamuscarse con los mecheros si nos aproximamos a ellos.
- Las manos siempre han de estar secas, sobre todo al manejar aparatos eléctricos.
- Pipeteado: nunca pipetear con la boca, utiliza los pipeteadores.
- Orden en la mesa: coloca los materiales hacia el centro de la mesa, nunca en los bordes.
- Calentamiento de tubos de ensayo: mantenerlos inclinados, orientando su abertura hacia donde no halla nadie.
- No verter sustancias por encima del nivel de los ojos.
- Usa mascarilla, gafas protectoras o guantes cuando sea necesario.
- El vidrio es frágil y caro, manipúlalo con mucho cuidado.
- El vidrio puede tener bordes cortantes.
- No enfriar bruscamente un vidrio caliente.
Normas de limpieza en el Laboratorio
- No echar productos sólidos a a los fregaderos, salvo si están finamente pulverizados y es poca la cantidad a eliminar.
- Los residuos así como los materiales rotos deposítalos en la papelera.
- El material debe quedar limpio, seco y en su lugar correspondiente.
- Los productos químicos usados y sobrantes no se devuelven a las botellas.
- Utiliza las escobillas para una limpieza minuciosa de pipetas, tubos de ensayo…
- Los fregaderos y encimeras deben quedar limpios.
- Al finalizar las mesas quedaran limpias y secas.
Enlaces
Recursos didácticos / recursos
- Selectividad
- Materiales : se encuentran a disposición del alumnado en classroom
- Calendario actuaciones: Las fechas de exámenes de pendientes del curso anterior se encuentran publicadas en el tablón de anuncios anexo al Departamento